miRNA의 발견과 AI기반 단백질 구조 규명
- 생리학교실 장수환 교수 -
우리 몸에서 단백질을 합성하는 데 필수 역할을 하는 리보핵산(RNA)의 작용 원리가 밝혀진 후 이를 활용한 난치병 치료제 시장이 빠르게 커지고 있다. 올해 노벨상 수상자에는 이 단백질에 대한 연구자들이 많이 등장한다. 마이크로 리보핵산(miRNA)을 발견한 노벨 생리의학상 수상자들과 단백질의 3차원 구조를 설계하고 예측하는데 기여한 노벨 화학상 수상자들을 만나보자.
올해 노벨 생리의학상은 빅터 앰브로스 미국 매사추세츠의대 교수와 게리 러브컨 미국 하버드의대 유전학 교수가 수상했다. 이들은 ‘예쁜 꼬마선충’이라는 선형동물 모델에서 lin-4라 이름 붙여진 작은 조절자 리보핵산이 Lin-14라는 유전자 발현을 조절한다는 사실을 최초로 밝혔다(Cell, 1993). 또한 이들은 짧은 리보핵산이 단백질을 생산하도록 만들어진 전령 리보핵산의 단백질로 번역되지 않는 부분(Untranslated Region, UTR)에 결합해, 전사 후 단백질 생산을 저해한다는 것을 발견했다. 크기가 너무 작아 일반적인 분자생물학적 방법으로 검출하기도 힘든 작은 리보핵산이 무슨 기능이 있을까 할 수 있다. 하지만 이후 연구에서는 인간에 1,000종 이상 마이크로 리보핵산이 존재하며 수많은 유전자의 정밀한 발현 조절을 담당한다는 사실을 밝히게 된다. 마이크로 리보핵산은 암이나 신경질환 등 다양한 질환에서 중요한 조절자 역할을 하는 것으로 알려져 있다. 예를 들면 대표적인 발암성 마이크로 리보핵산인 miR-155는 과발현될 경우 단독으로 B세포 림프종을 유발하는 것으로 알려졌다.
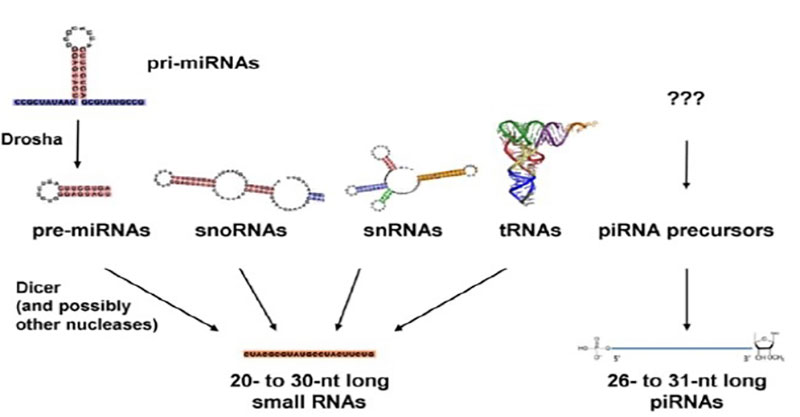 ▲ [그림1] 우리 세포 속의 다양한 작은 NA들(Sci World, 2010)
▲ [그림1] 우리 세포 속의 다양한 작은 NA들(Sci World, 2010)
필자는 2008년 박사후연구원으로 일하던 미국 암 연구소(NCI)에서 우연히 마이크로 리보핵산 연구에 입문했다. 한국인 동료가 자체 개발한 ‘microRNA array’라는 것을 연구에 한번 사용해 보라고 제안한 이후 마이크로 리보핵산이라는 새로운 세계에 빠져들어 연구를 거듭했다. 연구를 하면 할수록 놀랍고 다양한 기능들을 조금이나마 더 이해할 수 있었다. 마이크로 리보핵산은 수십, 수백 개의 유전자 발현을 조금씩 동시에 조절한다. 이러한 특성 때문에 임상에서 직접적인 치료제 개발은 어려운 측면이 있으나 그 특유의 안정성을 감안하면 바이오마커로서 큰 잠재력이 있다고 본다. 마이크로 리보핵산의 발견 이후 이어진 후속 연구들로 마이크로 리보핵산뿐 아니라 다양한 작은 리보핵산(piwi-RNA, sno-RNA, tsRNA 등)이 발견되며 이 작은 리보핵산 조절자들의 생물학적 기능을 밝히는 것이 연구자들에게 새로운 도전이 되고 있다. [그림1]
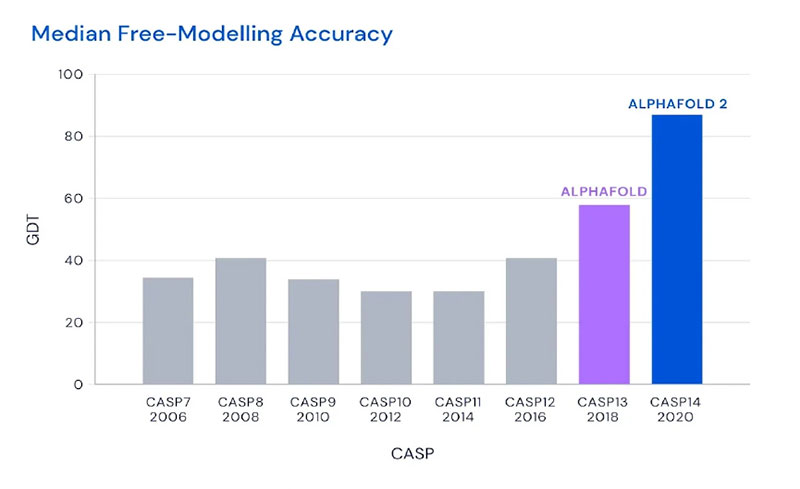 ▲ [그림2] 기존 ASP 우승작들과 알파폴드2의 구조예측 성능 비교
▲ [그림2] 기존 ASP 우승작들과 알파폴드2의 구조예측 성능 비교
한편 올해 노벨 화학상은 단백질 설계 및 인공지능을 이용해 단백질 구조예측 분야를 연구한 3인이 수상했다. 데이비드 베이커 미국 워싱턴대 교수와 데미스 하사비스 영국 구글 딥마인드 최고경영자, 존 점퍼 구글 딥마인드 수석연구원이 그들이다. 단백질 구조예측 분야는 한때 신의 영역이라고까지 불리던 매우 어려운 연구 분야다. 흥미로운 것은 2년마다 열리는 ‘세계 단백질 구조예측 대회(CASP, The Critical Assessment of protein Structure Prediction)’에서 세계 최고의 기량을 뽐내던 그룹이 바로 데이비드 베이커 교수팀이었다.
 ▲ [그림3] 알파폴드3을 이용한 단백질 DNA 결합구조 예측(Nature, 2024). 위쪽이 단백질의 3차원 구조, 아래쪽이 DNA 이중나선구조
▲ [그림3] 알파폴드3을 이용한 단백질 DNA 결합구조 예측(Nature, 2024). 위쪽이 단백질의 3차원 구조, 아래쪽이 DNA 이중나선구조
그런데 2018년 CASP에서는 구글 딥마인드의 AI모델인 알파폴드(Alphafold)가 혜성같이 등장해 1등을 차지했다. 2020년에는 한층 더 업그레이드된 알파폴드 2가 90점에 가까운 성능을 보이며 기존 알고리즘을 완전히 뛰어넘게 된다. (그림2) 이 알파폴드를 주도적으로 개발한 사람이 바로 데미스 하사비스와 존 점퍼다. 올해 6월에는 알파폴드 3가 소개됐는데 기존 단일 단백질 구조와 단백질-단백질 결합 구조예측을 넘어 단백질-핵산, 단백질-라이간드까지 예측구조 범위를 확장했다. [그림3]
이러한 인공지능 기반 단백질 구조예측 기술의 발전은 단백질이 일반 약물의 타겟임을 고려할 때 구조기반 약물디자인이라는 신약개발 분야를 크게 발전시킬 것으로 기대한다. 이미 많은 기업들이 앞다투어 이 분야에 투자하고 있다. 하지만 단백질은 아미노산 외에도 다양한 성분으로 구성돼 있다. 항체와 같이 진화적인 정보가 없거나 막단백질처럼 주변환경에 따라 구조가 변화하기도 하기 때문에 풀어야 할 숙제들이 많다. 미래에 더 발전된 고도의 AI기술이 이런 난제들을 어떻게 극복하는지 함께 지켜보자. 기술을 활용한 많은 표적 치료제들이 개발돼 더 많은 난치성 질환 환자들에게 건강을 선물할 날을 기대해 본다.












