항체-약물 접합체(ADC): 정밀 타격 뒤에 숨은 난제들
암세포만 공격하는 ‘유도미사일’
암 치료의 역사는 “어떻게 하면 정상세포는 살리고 암세포만 죽일 수 있을까”라는 질문을 푸는 과정이었습니다. 기존 항암제는 이 질문에 속 시원한 답을 주지 못했습니다. 빠르게 증식하는 세포를 무차별적으로 공격하는 방식이었기 때문에 탈모, 구토 등 심각한 부작용이 불가피했습니다. 암세포뿐 아니라 정상적으로 빠르게 자라는 모낭세포와 장점막세포까지 함께 공격한 것입니다.
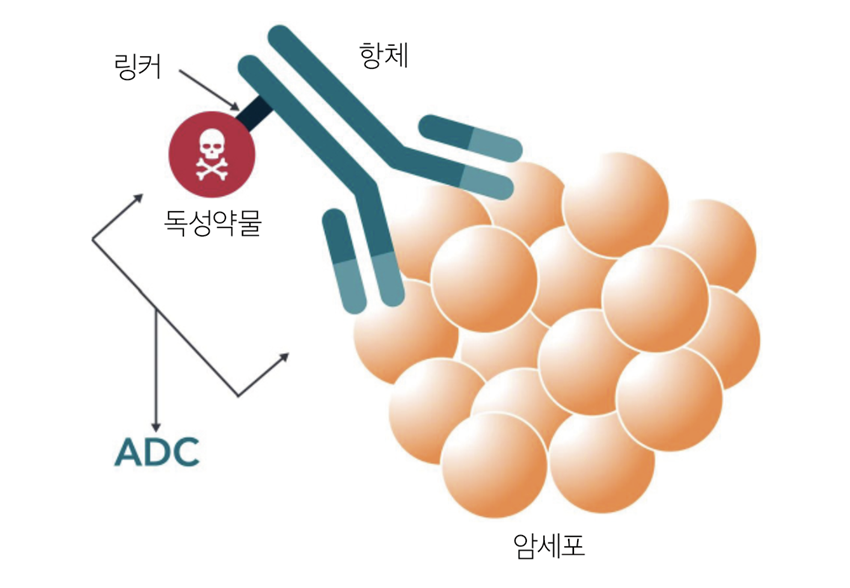
표적 항암제인 글리벡(Gleevec)의 등장으로 환자 맞춤형 표적 치료가 가능하다는 미래 비전이 제시된 2000년대, 이 오랜 숙제에 또 하나의 해법이 등장했습니다. 바로 항체-약물 복합체(Antibody-Drug Conjugate, ADC)입니다. ADC는 마치 정밀한 유도미사일처럼 작동합니다. 암세포 표면의 특정한 단백질을 정확히 인식하는 ‘항체’가 유도 시스템, 암세포를 죽이는 강력한 독성 약물이 탄두 역할을 합니다. 그리고 이 둘을 연결하는 ‘링커’가 기폭 장치처럼 정확한 시점에 정확한 위치에서만 독성 약물이 방출되도록 조절합니다. 정상세포를 지나쳐 암세포에서만 약물을 방출하는 이 정교한 시스템은 화학물질과 생물학물질의 장점을 결합한 차세대 항암제로 주목받았습니다.
예상치 못한 복병, DAR
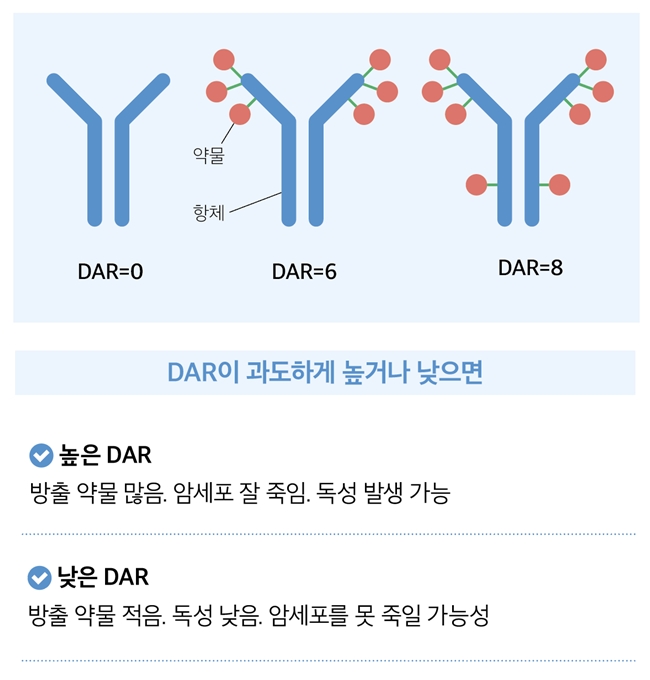
이론적으로 완벽해 보이던 ADC는 실제 개발 과정에서 난관에 부딪혔습니다. 핵심 문제는 항체 한 개당 결합된 약물의 개수를 뜻하는 ‘DAR(Drug-Antibody Ratio)’이었습니다. 원인은 링커 기술의 문제로 드러났죠. ADC 제조 초기에는 항체 표면에 독성 약물을 무작위로 붙이는 방식을 적용했습니다. 마치 폭격기에 폭탄을 대충 실어 보내는 것과 같았습니다. 어떤 항체에는 약물이 하나도 달려 있지 않은 반면 어떤 항체에는 8개씩 매달려 있었습니다. 평균 DAR이 3.5라 해도 실제로는 0부터 8까지 제각각이었던 것입니다. 이 불균일성의 결과는 치명적이었습니다. 약물이 적게 붙은 ADC는 암세포에 도달해도 충분한 독성을 발휘하지 못해 암세포를 죽이지 못했고, 약물이 너무 많이 붙은 ADC는 정상세포까지 손상시켰습니다. 약물 탑재량이 일정하지 않으니 ADC의 투여 효과를 예측하는 것 자체가 불가능했습니다.
이로 인해 약물의 유효성과 안전성이 확보되는 용량 범위, 치료역(therapeutic window)의 문제가 대두되었습니다. 정확하게는 치료 효과가 나타나는 최소 용량(또는 혈중농도)과 허용할 수 없는 독성이 나타나는 최소 용량(또는 혈중농도) 사이 범위를 말하는데, DAR이 불균일하면 이 범위가 너무 좁아지는 것이었습니다. 약물 용량을 조금만 올려도 심각한 부작용이 나타나고 용량을 줄이면 효과가 없어지는 것이었습니다.
DAR 이슈와 더불어 링커의 안정성 문제도 간과할 수 없었습니다. 링커는 정상세포의 중성 환경에서는 안정적으로 유지되다가 암세포 내부의 산성 환경(pH 4.5~5.0), 카텝신과 같은 특정 효소를 만나야만 끊어져 약물을 방출하도록 설계되었습니다. 그러나 링커가 혈액 속을 순환하는 동안 예상보다 훨씬 일찍 분해돼 약물이 정상조직에 노출되는 조기 절단(Premature Cleavage) 현상이 발생했습니다. 실제로 혈액 내에서 시간이 경과함에 따라 DAR이 크게 감소하는 것으로 나타났죠. 마치 폭격기가 목표 지점에 도착하기 전 민간 지역에 폭탄을 떨어뜨리는 것처럼 일찍 방출된 약물이 정상조직을 사멸시키는 부작용이 드러난 것입니다.
실패가 남긴 값비싼 교훈
이러한 문제들은 임상시험에서 극명하게 드러났습니다. 항암제 독소루비신(Doxorubicin)을 탑재한 최초의 ADC인 SGN-15(BR96-DOX)는 링커가 혈액 내에서 쉽게 분해돼 정상조직에 약물이 노출되면서 임상 승인에 실패했습니다. 링커 불안정성으로 인한 조기 약물 방출 문제가 심각했고 2상에서 비소세포폐암 환자를 대상으로 효과를 입증하는 데 실패했죠.
또 다른 사례는 2000년 급성골수성백혈병 치료제로 승인까지 받은 ADC인 마일로탁(Mylotarg)입니다. 평균 DAR이 2~3이었지만 실제로는 불균일하게 분포했기 때문에 간독성, 특히 간정맥폐쇄증과 골수억제 등 치명적 부작용이 발생했습니다. 결국 확증 임상시험에서 생존율 개선을 입증하지 못하고 오히려 치료군에서 조기 사망이 더 많이 발생해 2010년 시장에서 퇴출되었습니다. ADC 분야에 큰 충격을 안긴 사건이었습니다.
현재 사용 중인 ADC들도 이 문제로부터 완전히 자유롭지는 못합니다. HER2 양성 유방암 치료제로 널리 쓰이는 캐싸일라(Kadcyla)는 평균 DAR이 3.5로 설계됐지만 실제로는 DAR이 0에서 8까지 불균일하게 분포합니다. 이로 인해 혈소판감소증, 간독성, 폐독성 같은 부작용이 보고되고 있습니다. 높은 DAR을 가진 ADC가 대식세포에 흡수되면서 과도한 독성 효과로 인해 정상세포까지 사멸시키는 것이죠.
최근 큰 주목을 받고 있는 차세대 ADC인 엔허투(Enhertu)는 또 다른 측면의 문제를 보여줍니다. 평균 DAR이 8로 상당히 강력한 항암 효과를 보이는 동시에 생산 측면에서도 DAR이 8을 유지하는 균일성을 유지하는 데 성공했지만, 10% 전후의 환자에서 간질성 폐질환과 같은 폐독성이 확인됐습니다. 강력한 독성 약물인 데룩스테칸(Deruxtecan)의 세포 투과성이 높아 암세포를 죽인 후에도 주변 정상조직으로까지 독성이 확산되는 ‘바이스탠더 효과(bystander effect)’가 주요 원인 중 하나로 지목됐습니다. 높은 DAR과 강력한 페이로드가 만나면서 치료역이 좁아진 전형적인 사례입니다. 이러한 실패들이 쌓여 DAR과 링커의 안전성 문제를 근본적으로 해결할 수 있는 방안을 찾아나가게 됩니다.













